Изменение кислотно основных свойств по периодам и группам. Изменение свойств элементов в периодах и главных подгруппах. Химические элементы - неметаллы
В разделе на вопрос химия. как изменяются металлические и неметаллические свойства в группе и в периоде. заданный автором Невролог
лучший ответ это в пределах одного и тогоже периода металлические свойства ослабевают, а неметалические усиливаются,
В пределах одной и той же группы (в главной подгруппе) металические свойства усиливаются, а неметалические ослабевают
Ответ от Натурфилософия
[активный]
1. При перемещении СПРАВА НАЛЕВО вдоль ПЕРИОДА МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении - возрастают неметаллические.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
Ответ от упроститься
[гуру]
В периоде с возрастанием заряда ядра атома металлические свойства ослабевают, т. к. увеличивается число электронов на последнем слое.
В подгруппе с возрастанием заряда ядра металлические свойства усиливаются, т. к. увеличивается радиус атома и отдавать электроны становится легче. . Наиболее активным металлом является франций.
Ответ от Олеся кувалина
[новичек]
Ого
Период периодической системы на Википедии
Период периодической системы
Периодическая система химических элементов на Википедии
Посмотрите статью на википедии про Периодическая система химических элементов
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра.
б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов.
1. СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ - ВОССТАНОВИТЕЛЬНЫЕ свойства элементов.
2. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО , достигая максимума у галогенов.
3. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ . Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее.
в) Закономерности, связанные с размерами атомов.
1. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ .
2. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ , потому что заполнено больше электронных оболочек.
Вопрос 3.
Строение вещества. Гибридизация орбиталей. Типы химических связей. Потенциал ионизации и электроотрицательность.
Строение вещества
Все тела состоят из отдельных частиц - молекул и атомов. Молекулы - это наименьшие частицы вещества. Молекулы состоят из атомов.
Основные сведения о составе вещества:
1) Все тела состоят из отдельных частиц (молекул и атомов), между которыми есть промежутки.
2) Молекулы непрерывно и хаотично движутся.
3) Молекулы взаимодействуют между собой (притягиваются и отталкиваются).
Свойства молекул:
1) Молекулы одного и того же вещества одинаковы.
2) При нагревании промежутки между молекулами увеличиваются, а при охлаждении - уменьшаются.
3) С увеличением температуры, скорость движения молекул возрастает.
По типу строения все вещества делятся на молекулярные и немолекулярные . Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные.
По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы).
Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах.
Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H 2 , O 2 , N 2 , Cl 2 , Br 2 , S 8 , P 4 и другие простые вещества; CO 2 , SO 2 , N 2 O 5 , H 2 O, HCl, HF, NH 3 , CH 4 , C 2 H 5 OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях.
Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO 2 , SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.)
Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде.
Гибридизация орбиталей
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
sp 3 - Гибридизация
. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28". Молекулы, в которых осуществляется sp 3 - гибридизация, имеют тетраэдрическую геометрию (CH 4 , NH 3).
sp 2 - Гибридизация
. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°.
Молекулы, в которых осуществляется sp 2 - гибридизация, имеют плоскую геометрию.
sp- Гибридизация
. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
Типы химических связей.
1) Ионная (металл + неметалл)
2) Ковалентная
(неметалл + неметалл с помощью общих электронных пар)
Виды: * полярная (разные неметаллы)
* неполярная (одинаковые неметаллы)
Виды: * образована обменным механизмом
* образована донорно-акцепторным механизмом
Обменный механизм - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. Каждый из атомов предоставляет в общее пользование по одному электрону:
Донорно-акцепторный механизм (координационная связь) - химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора) .
3) Металлическая (между атомами металлов, между ионами металлов и общими свободными электронами)
4) Водородная (между водородом одной молекулы и другим более электроотрицательным элементом (O, S, N, F) и с другой молекулой)
Потенциал ионизации атома - минимальная разность потенциалов U , которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома.
Электроотрицательность (ЭО) – относительная способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей.
Вопрос № 3 Как изменяются свойства химических элементов в периодах и главных подгруппах? Объясните эти закономерности с точки зрения теории строения том.
Ответ:
I. С возрастанием порядкового номера элемента в периоде уменьшаются металлические свойства элементов и увеличиваются неметаллические, кроме этого, в периодах (малых) валентность элементов в соединениях с кислородом возрастает от 1 до 7, слева направо. Эти явления объясняются строением атомов:
1) С увеличением порядкового номера в периоде постепенно заполняются электронами внешние энергетические уровни, количество электронов на последнем уровне соответствует номеру группы и высшей валентности в соединениях с ки-слородом.
2) С увеличением порядкового номера в периоде увеличивается заряд ядра, что вызывает увеличение сил притяжения электронов к ядру В результате радиусы атомов уменьшаются, поэтому способность атомов отдавать электроны (металлические свойства) постепенно ослабевает и последние элементы периодов являются типичными неметаллами.
Пояснительная записка Тематический тест « Закономерности изменения химических свойств элементов и их соединений по периодам и группам» предназначен для подготовки учащихся к Единому Государственному экзамену по химии. Целевая аудитория - 11 класс. Формулировки тестовых заданий соответствуют демонстрационной версии контрольно-измерительных материалов по химии 2018 года.
Задания составлены по аналогии с тестами, опубликованными в пособии «ЕГЭ. Химия: типовые экзаменационные варианты: 30 вариантов/ под ред. А.А. Кавериной», вышедшем в издательстве «Национальное образование» (Москва, 2017 год)
Закономерности изменения химических свойств элементов и их соединений по периодам и группам
| 1) Cl | 2) K | 3) Si | 4) S | 5) O |
- Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке уменьшения их электроотрицательности.
Запишите в поле ответа номера выбранных элементов в нужной последовательности.
Ответ:
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке возрастания кислотных свойств их водородных соединений.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке уменьшения их металлических свойств.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания кислотных свойств их высших гидроксидов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке увеличения числа внешних электронов в атомах этих элементов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке возрастания радиуса их атомов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одном периоде. Расположите выбранные элементы в порядке усиления окислительных свойств их атомов.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе. Расположите выбранные элементы в порядке усиления основных свойств образуемых ими оксидов.
Из указанных в ряду химических элементов выберите три металла. Расположите выбранные элементы в порядке уменьшения восстановительных свойств.
Из указанных в ряду химических элементов выберите три элемента, которые в Периодической системе химических элементов Д.И. Менделеева находятся в одной группе.
Расположите эти элементы в порядке увеличения силы притяжения валентных электронов.
Ответы
Вопрос 1
Вопрос 2
Вопрос 3
Немного теории
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса»
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов». Периодичность - это повторяемость (цикличность) явления через определенные промежутки времени.
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная Менделеевым Периодическая система элементов. Свойства атомов и их соединений повторяются через определенные промежутки (периоды).
Периодом в периодической системе называется последовательность элементов, расположенных в порядке возрастания заряда ядра, начинающаяся водородом или щелочным металлом и заканчивающаяся инертным газом. Началу периода соответствует начало заполнения электронами нового энергетического уровня.
Элементы, расположенные в одном вертикальном столбце короткой формы периодической таблицы, образуют одну группу . Каждая группа состоит из двух подгрупп. Подгруппы, в которые входят элементы как больших, как и малых периодов, называются главными. В короткой форме таблицы символы элементов, относящихся к главной и побочной подгруппам одной группы, записывают со смещением к противоположным краям клетки, так что они образуют как бы две вертикальные последовательности в пределах одного столбца. в длинной форме таблицы их помещают в разных столбцах, обозначая как подгруппы А и Б. В любой из главных подгрупп (А) электронные конфигурации элементов аналогичны, т.е. на внешнем уровне имеется одинаковое количество электронов. Вследствие этого такие элементы обнаруживают большое сходство между собой, что конкретно проявляется в сходстве образуемых ими простых и сложных веществ. Иными словами, элементы одной главной подгруппы – полные аналоги.
Основные закономерности изменения свойств в периодах:
1. Возрастает электроотрицательность элемента, т.е. уменьшается способность атомов терять электроны и увеличивается способность присоединять их. Это связано с увеличением заряда ядра, вследствие чего внешние электроны, находящиеся на одном уровне, все сильнее притягиваются ядром. В результате в начале периода находятся типичные электроположительные элементы (металлы), а в конце периода, перед инертными газами – типичные электроотрицательные элементы (неметаллы).
2. Увеличивается максимальная положительная степень окисления, равная числу электронов на внешнем уровне, т.е. номеру группы, за исключением кислорода и фтора.
3. Для электроотрицательных элементов убывает по абсолютной величине отрицательная степень окисления, равная восьми минус номер группы.
4. Ослабевают основные свойства оксидов и гидроксидов элементов и одновременно усиливаются их кислотные свойства.
В главных подгруппах с увеличением заряда ядра свойства элементов, а также соответствующих им простых веществ и соединений изменяются следующим образом:
1. Уменьшается электроотрицательность элемента, соответственно усиливаются металлические свойства и ослабевают неметаллические. Например, в V группе азот – типичный неметалл, фосфор – неметалл, у которого одно из аллотропных видоизменений обладает значительной электропроводностью (черный фосфор), мышьяк и сурьма – элементы, занимающие промежуточное положение между типичными металлами и типичными неметаллами, и, наконец, висмут – металл.
2. Усиливаются основные свойства оксидов и гидроксидов. (Следует помнить, что кислотно-основные свойства оксида или гидроксида зависят еще и от степени окисления элемента. Поэтому сравнивать следует соединения с одинаковыми степенями окисления элементов-аналогов).
Изменение атомных радиусов:








 Уравнения онлайн Реши уравнение х 4
Уравнения онлайн Реши уравнение х 4 Экономика. Спрос и предложение. Равновесная цена Спрос больше предложения то на рынке
Экономика. Спрос и предложение. Равновесная цена Спрос больше предложения то на рынке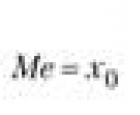 Децильный коэффициент дифференциации доходов населения
Децильный коэффициент дифференциации доходов населения Тригонометрические тождества примеры доказательства
Тригонометрические тождества примеры доказательства